FÍSICA APLICADA Y FISICOQUÍMICA I
GRADO EN FARMACIA
Curso 2022/2023
1. Datos de la asignatura
(Fecha última modificación: 02-06-22 12:13)- Código
- 100104
- Plan
- 201
- ECTS
- 5.00
- Carácter
- BÁSICA
- Curso
- 1
- Periodicidad
- Primer cuatrimestre
- Idioma
- ESPAÑOL
- Área
- QUÍMICA FÍSICA
- Departamento
- Química Física
- Plataforma Virtual
Datos del profesorado
- Profesor/Profesora
- María Jesús Sánchez Montero
- Grupo/s
- 1
- Centro
- Fac. Farmacia
- Departamento
- Química Física
- Área
- Química Física
- Despacho
- 063
- Horario de tutorías
- Concertar cita previamente
- URL Web
- https://produccioncientifica.usal.es/investigadores/57463/detalle
- chusan@usal.es
- Teléfono
- 677554863
- Profesor/Profesora
- Susana Raquel Gómez Carrasco
- Grupo/s
- 2
- Centro
- Fac. Ciencias Químicas
- Departamento
- Química Física
- Área
- Química Física
- Despacho
- 062 (Fac. Farmacia); C3505 (Fac. CC. Químicas)
- Horario de tutorías
- Ma. y Jue. 16 - 19 h
- URL Web
- https://produccioncientifica.usal.es/investigadores/57174/detalle
- susana.gomez@usal.es
- Teléfono
- 666589074 / EXT: 6280
- Coordinador/Coordinadora
- María del Pilar García Santos
- Grupo/s
- 3+4
- Centro
- Fac. Ciencias Químicas
- Departamento
- Química Física
- Área
- Química Física
- Despacho
- C2501 - EDIFICIO FACULTAD DE CC. Y CC. QUÍMICAS
- Horario de tutorías
- Concretar cita en clase o por correo electrónico
- URL Web
- http://alquilnitrosos.usal.es/ // https://produccioncientifica.usal.es/investigadores/56806/detalle
- pigarsan@usal.es
- Teléfono
- 670546560
- Profesor/Profesora
- Pablo García Jambrina
- Grupo/s
- Laboratorio
- Centro
- Fac. Farmacia
- Departamento
- Química Física
- Área
- Química Física
- Despacho
- 061
- Horario de tutorías
- Consultar por correo electrónico
- URL Web
- https://produccioncientifica.usal.es/investigadores/148311/detalle
- pjambrina@usal.es
- Teléfono
- Ext. 4486
- Profesor/Profesora
- Ana María Sánchez Hernández
- Grupo/s
- Laboratorio
- Centro
- Fac. Farmacia
- Departamento
- Química Física
- Área
- Química Física
- Despacho
- C2504 (Facultad de Ciencias Químicas)
- Horario de tutorías
- Lu y Mi. 10 - 12 h. Se recomienda pedir cita por correo electrónico
- URL Web
- http:/fisquim.usal.es
- anamsh@usal.es
- Teléfono
- Ext. 4486
2. Sentido de la materia en el plan de estudios
Bloque formativo al que pertenece la materia.
Bloque formativo: (Libro Blanco. Licenciatura Farmacia. ANECA)
Área 1: Química. (Fisicoquímica, Química orgánica, Química inorgánica, Técnicas Instrumentales, Química Farmacéutica)
Papel de la asignatura.
La asignatura Física Aplicada y Fisicoquímica I aporta las bases teóricas para:
- El análisis de propiedades de sistemas fisicoquímicos (Sustancias Químicas; Disoluciones; Mezclas…)
- La cuantificación y determinación del sentido y extensión de los cambios en los sistemas fisicoquímicos (Cambio de estado, Reacción Química)
- La interpretación y cuantificación de los cambios en la funcionalidad de sistemas biológicos (Bioquímica, Fisiología)
- La interpretación y cuantificación de los procesos fisicoquímicos asociados a la producción y uso de los medicamentos (Tecnología Farmacéutica, Farmacocinética)
Perfil profesional.
Investigación, Farmacia Asistencial, Industria Farmacéutica o afines
3. Recomendaciones previas
Buen nivel de conocimiento en Química General, Física General y Matemáticas (Análisis y Cálculo numérico).
Habilidades y destrezas en el uso de recursos informáticos (Paquetes ofimáticos, Internet, Bases de Datos, etc.)
4. Objetivo de la asignatura
1. Generales
- Mostrar la potencialidad y posibilidades de las leyes y principios fisicoquímicos como base para la interpretación y predicción del sentido y extensión de los procesos que se integran en la evolución de los sistemas Químicos, Biológicos y Tecnológicos
- Identificar y analizar procesos fisicoquímicos que se integran en sistemas de interés farmacéutico
2. Específicos
- Conocer, comprender y aplicar los principios y leyes del Método Termodinámico a la interpretación y cuantificación de los procesos asociados con:
- Cambios de estado
- Propiedades de Disoluciones y Mezclas
- Equilibrio de Fases
- Equilibrio Químico
5. Contenidos
Teoría.
MÓDULO 1: TERMODINÁMICA APLICADA A LA QUÍMICA Y DISOLUCIONES
Objetivos de Aprendizaje
- Familiarizar al estudiante con la metodología termodinámica y con las matemáticas necesarias para su desarrollo.
- Comprender el interés de la termodinámica en la predicción de la evolución espontánea de los procesos fisicoquímicos.
- Saber aplicar la termodinámica al estudio de la energética de las reacciones químicas y entender por qué es importante dicho estudio.
- Saber aplicar la termodinámica al estudio de las propiedades de las disoluciones y de los equilibrios entre fases
Contenidos
Sección 1.1: Fundamentos de Termodinámica
Capítulo 1.1.1: Energía de los sistemas. Método termodinámico: Conceptos básicos. Ecuación de estado. Energía de los sistemas: Primer Principio de la Termodinámica. Variaciones de energía en cambios de estado. Entalpía. Energética de las reacciones químicas.
Capítulo 1.1.2: Espontaneidad y equilibrio. Segundo principio de la Termodinámica: Entropía. Entropía de cambios de estado. Tercer principio de la Termodinámica. Energía libre de Gibbs. Potencial químico. Condición general de equilibrio físico. La regla de las fases.
Sección 1.2: Termodinámica de las Disoluciones
Capítulo 1.2.1: Disoluciones de comportamiento ideal y no ideal. Disoluciones líquidas: Diagramas de fases. Disolución líquida ideal: Ley de Raoult. Desactivaciones de la Ley de Raoult. Disolución líquida diluida. Ley de Henry. Conceptos de actividad y coeficiente de actividad.
Capítulo 1.2.2: Disoluciones de no electrolitos. Propiedades coligativas: Descenso de la presión de vapor, aumento de la temperatura de ebullición, descenso de la temperatura de congelación, presión osmótica. Solubilidad y reparto.
Capítulo 1.2.3: Disoluciones de electrolitos.- Concepto de actividad y coeficiente de actividad iónico medios. Teoría de Debye-Huckel para el cálculo de los coeficientes de actividad. Propiedades coligativas de las disoluciones de electrolitos. Concepto de osmolaridad.
MÓDULO 2: EQUILIBRIO QUÍMICO
Objetivos de Aprendizaje
- Utilizando lo aprendido en el módulo anterior, el estudiante debe comprender las características del equilibrio químico y los factores que influyen en él.
- Entender las características de algunos equilibrios de especial importancia en los seres vivos, como los equilibrios acoplados y múltiples.
- Con la metodología general del equilibrio químico, entender los aspectos particulares de los equilibrios iónicos: disociación de electrolitos débiles, hidrólisis, disoluciones tampón, producto de solubilidad, etc.
- Saber aplicar la misma metodología al estudio de reacciones redox (equilibrios electroquímicos).
Contenidos
Capítulo 2.1: Tratamiento general del equilibrio químico. Condición de equilibrio químico para una reacción reversible. Constante termodinámica de equilibrio. Equilibrio químico en gases. Equilibrio químico en disolución líquida. Sistema de referencia bioquímico. Influencia de la temperatura y la presión sobre el equilibrio químico.
Capítulo 2.2: Equilibrios complejos. Equilibrios simultáneos. Equilibrios acoplados.
Capítulo 2.3: Equilibrios iónicos. Constante de disociación de ácidos y bases monopróticos. Efecto salino. Producto de solubilidad de una sal poco soluble. Equilibrio electroquímico.
Práctica.
MODULO: PRÁCTICAS DE LABORATORIO
Objetivos de Aprendizaje
- Familiarizar al estudiante con técnicas básicas utilizadas en los laboratorios de Química: pesadas, disoluciones, valoraciones, pH-metros, termostatos, etc.
- Introducir al estudiante en las técnicas de análisis de datos: precisión, exactitud, cifras significativas, análisis dimensional, tablas, gráficas, y regresión lineal.
- Comprobar experimentalmente algunas de las leyes de la Fisicoquímica.
Contenidos
Se realizarán tres prácticas de laboratorio: preparación de disoluciones y valoración volumétrica, equilibrio químico y propiedades coligativas.
6. Competencias a adquirir
Básicas / Generales.
CB1: Que los estudiantes hayan demostrado poseer y comprender conocimientos en un área de estudio que parte de la base de la educación secundaria general, y se suele encontrar a un nivel que, si bien se apoya en libros de texto avanzados, incluye también algunos aspectos que implican conocimientos procedentes de la vanguardia de su campo de estudio.
CB2: Que los estudiantes sepan aplicar sus conocimientos a su trabajo o vocación de una forma profesional y posean las competencias que suelen demostrarse por medio de la elaboración y defensa de argumentos y la resolución de problemas dentro de su área de estudio.
CB3: Que los estudiantes tengan la capacidad de reunir e interpretar datos relevantes (normalmente dentro de su área de estudio) para emitir juicios que incluyan una reflexión sobre temas relevantes de índole social, científica o ética.
CB4: Que los estudiantes puedan transmitir información, ideas, problemas y soluciones a un público tanto especializado como no especializado.
CB5: Que los estudiantes hayan desarrollado aquellas habilidades de aprendizaje necesarias para emprender estudios posteriores con un alto grado de autonomía.
CG-1: Reconocer las propias limitaciones y la necesidad de mantener y actualizar la competencia profesional, prestando especial importancia al autoaprendizaje de nuevos conocimientos basándose en la evidencia científica disponible
Específicas.
CE1: Identificar, diseñar, obtener, analizar, controlar y producir fármacos y medicamentos, así como otros productos y materias primas de interés sanitario de uso humano o veterinario.
CEM1-2: Seleccionar las técnicas y procedimientos apropiados en el diseño, aplicación y evaluación de reactivos, métodos y técnicas analíticas.
CEM1-3: Llevar a cabo procesos de laboratorio estándar incluyendo el uso de equipos científicos de síntesis y análisis, instrumentación apropiada incluida.
CEM1-4: Estimar los riesgos asociados a la utilización de sustancias químicas y procesos de laboratorio.
CEM1-5: Conocer las características físico-químicas de las sustancias utilizadas para la fabricación de los medicamentos.
CEM1-6: Conocer y comprender las características de las reacciones en disolución, los diferentes estados de la materia y los principios de la termodinámica y su aplicación a las ciencias farmacéuticas.
CEM2-1: - Aplicar los conocimientos de Física y Matemáticas a las ciencias farmacéuticas.
CEM2-2: - Aplicar técnicas computacionales y de procesamiento de datos, en relación con información referente a datos físicos, químicos y biológicos.
CEM2-3: Diseñar experimentos en base a criterios estadísticos.
CEM2-4: Evaluar datos científicos relacionados con los medicamentos y productos sanitarios.
CEM2-5: Utilizar el análisis estadístico aplicado a las ciencias farmacéuticas
Transversales.
Instrumentales: Capacidad de aplicar los conocimientos a la práctica. Planificación y gestión del tiempo.
Interpersonales: Trabajo en equipo.
Sistémicas: Capacidad de aprender de forma autónoma.
7. Metodologías
Clases Magistrales (con apoyo de presentaciones en PowerPoint, pizarra, etc.)
Seminarios (resolución de problemas propuestos previamente a los estudiantes)
Clases Prácticas de Laboratorio
Otras actividades formativas (cuestionarios, trabajos en grupo, etc.)
Utilización de la plataforma virtual Studium
8. Previsión de Técnicas (Estrategias) Docentes
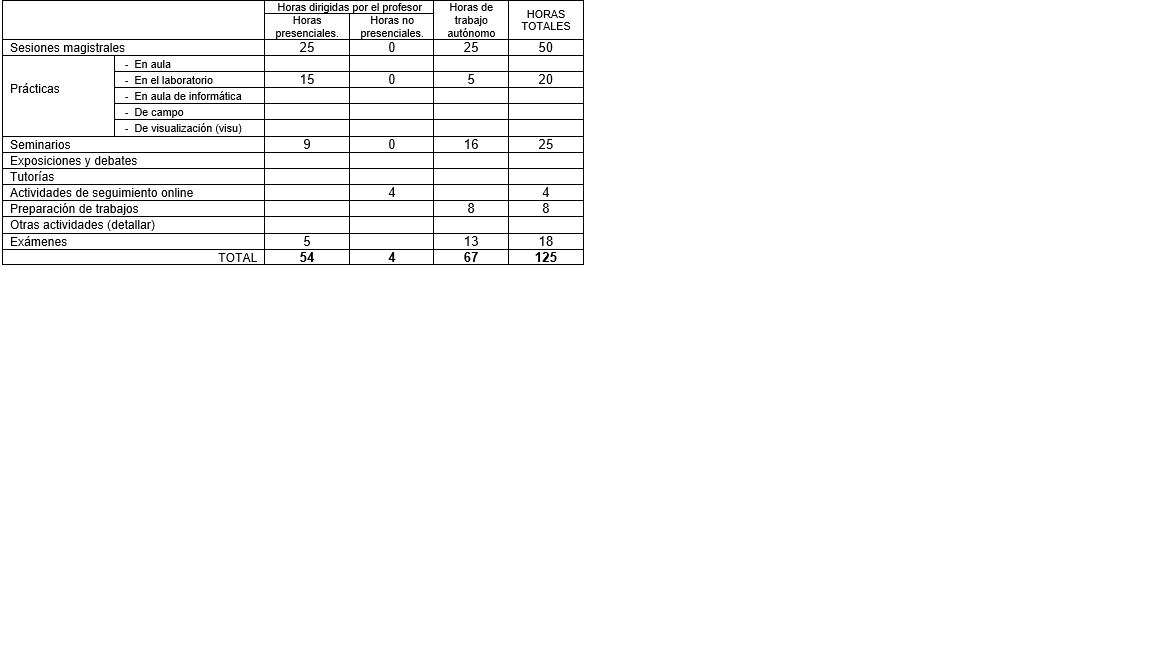
9. Recursos
Libros de consulta para el alumno.
- Fisicoquímica para Farmacia y Biología. P. SANZ PEDRERO. Ed: Masson-Salvat Medicina
- Química Física para estudiantes de Farmacia y Biología. S. C. WALLWORK y D. J. W. GRANT. Ed: Alhambra
- Physical Chemistry with applications to the biological sciences. Second edition. R. CHANG. Ed: McMillan Publishing Co.
- Physical Chemistry. Principles and applications to the biological sciences. Third edition. Tinoco, Jr., Sauer and Wang. Ed: Printece Hall
- Physical Chemistry with applications to the biological sciences. Second edition. D. Freifelder. Ed: Jones and Bartlett Publishers.
- Fisicoquímica. I. Levine. Ed: McGraw-Hill
- Fisicoquímica. Atkins. Ed: Addison-Wesley Iberoamericana
- Principios y problemas de Química Física para bioquímicos. N. C. Price y R. A. Dwek. Ed: Acribia.
Otras referencias bibliográficas, electrónicas o cualquier otro tipo de recurso.
- Webs y apuntes personales de los profesores
- Servidor de Apoyo del Departamento http://fisquim.usal.es/
10. Evaluación
Consideraciones generales.
En razón del número de alumnos matriculados en el curso, la evaluación se realizará contabilizando las calificaciones de las pruebas parciales, las prácticas de laboratorio y la participación en otras actividades.
Criterios de evaluación.
Convocatoria Ordinaria
Dos modalidades:
- Evaluación continua: Pruebas de conocimientos 70% (al menos dos de ellas en las fechas programadas por la Facultad), Prácticas de Laboratorio 15 % y otras actividades (cuestionarios, trabajos, entregas,….) 15 %.
- Evaluación no continua: Prueba de conocimientos 85% (en la fecha de la convocatoria ordinaria fijada por la Facultad) y Prácticas de Laboratorio 15 %.
El estudiante que se presente al primer examen parcial se considera que ha elegido la modalidad de evaluación continua.
Convocatoria Extraordinaria
Prueba de conocimientos (en la fecha programada por la Facultad para la convocatoria extraordinaria)
Los estudiantes que han elegido evaluación continua se examinarán de las partes no superadas. Calificación: pruebas de conocimientos 70%, prácticas de laboratorio 15% y otras actividades 15%.
Los estudiantes que han elegido evaluación no continua se examinarán de toda la asignatura. Calificación: prueba de conocimientos 85% y prácticas de laboratorio 15%.
Instrumentos de evaluación.
- Pruebas de conocimientos (teoría y problemas)
- Para la evaluación de las prácticas de laboratorio se tendrá en cuenta la actitud del estudiante en el laboratorio, las tareas solicitadas por el profesor y una prueba escrita (fundamento teórico, experimentación y resultados). La realización de las prácticas es condición necesaria para superar la asignatura.
- Trabajos en grupo
- Participación en actividades presenciales
- Participación en actividades en entornos virtuales
Recomendaciones para la evaluación.
Es fundamental la asistencia a clase y el trabajo diario desde el principio del curso.
Recomendaciones para la recuperación.
Repasar toda la asignatura y resolver más ejercicios. Solicitar tutorías para resolución de dudas conceptuales y de problemas.


